
Dr. Matthew Wheater
Onkologe University Hospital Southampton
Dr Wheater mit einem Überblick zur FOCUS Studie an 91 Patienten mit metastasiertem Uveamelanom. Dr Wheater erklärt Studiendesign, Patientenselektion und Ergebnisse.
Die FOCUS-Studie war die größte klinische LDT-Studie (lebergerichtete Therapie) zum metastasierten Aderhautmelanom.1-3

95 Patient*innen wurden in der CHEMOSAT-Studie aufgenommen; 91 Patient*innen erhielten die Behandlung.4,a

Bei einer lebensbedrohlichen Komponente des Aderhautmelanom in der Leber konnte bei den Patient*innen eine begrenzte extrahepatische Erkrankung der Knochen, der subkutanen Bereiche, der Lymphknoten oder der Lunge vorliegen. Eine extrahepatische Erkrankung musste mit einem definierten Behandlungsplan zur Resektion oder Bestrahlung behandelbar sein.4
Behandlungsplan
Die Patient*innen erhielten alle 6 bis 8 Wochen über bis zu 6 Behandlungszyklen eine Dosis von 3 mg/kg Melphalan unter Verwendung des CHEMOSAT-Verabreichungsystems.4,a
a Basierend auf dem idealen Körpergewicht (IKG; maximale Gesamtdosis, 220 mg)
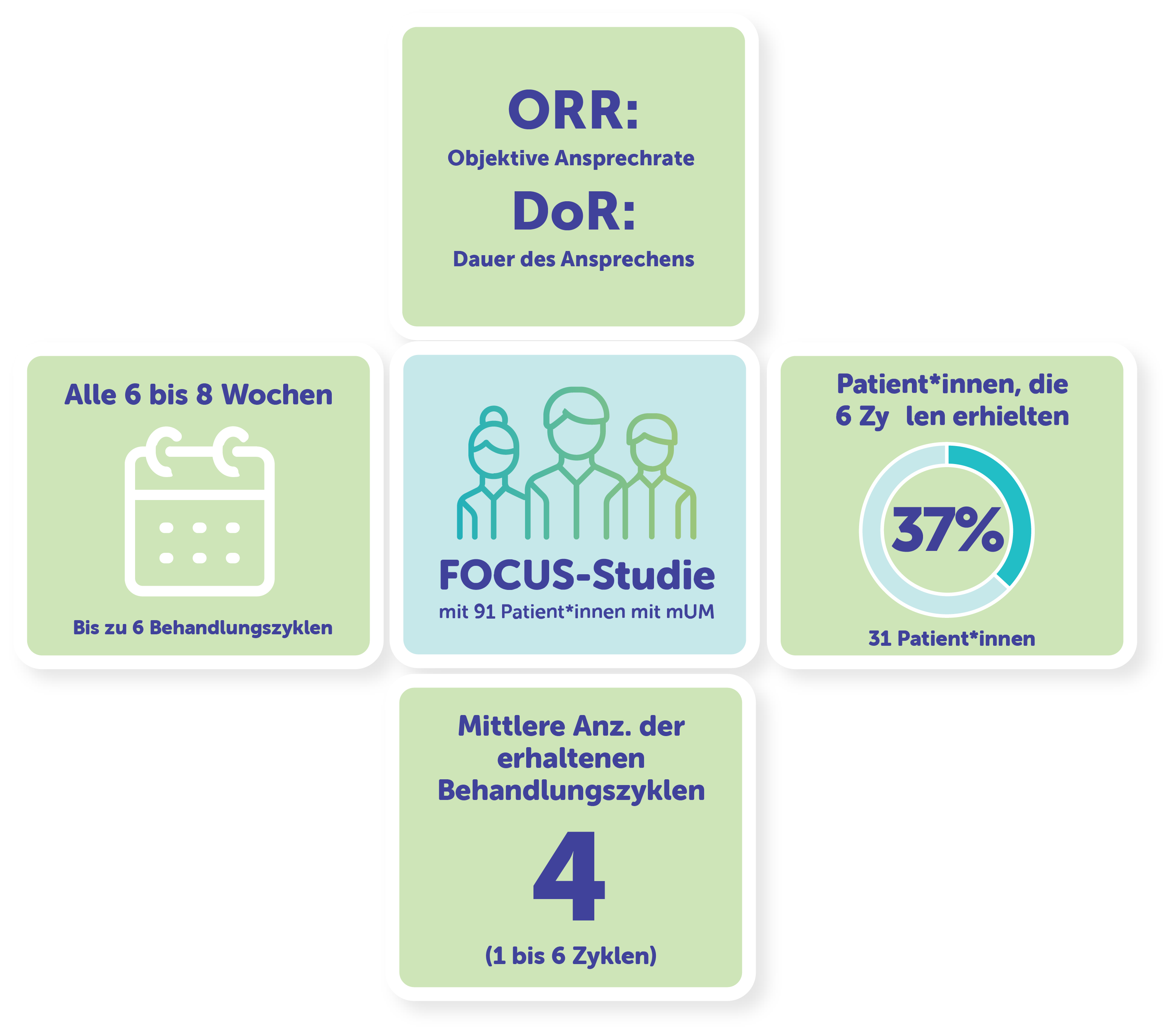
Mehr als 1/3 der Patient*innen sprachen auf die Behandlung mit CHEMOSAT an4
Die in der FOCUS Studie angegebene objektive Ansprechrate (ORR) betrug 36,6% (n=33)4
Die mittlere Dauer des Ansprechens bei den Patient*innen, die ansprachen (n=33), betrug 14 Monate.4,c
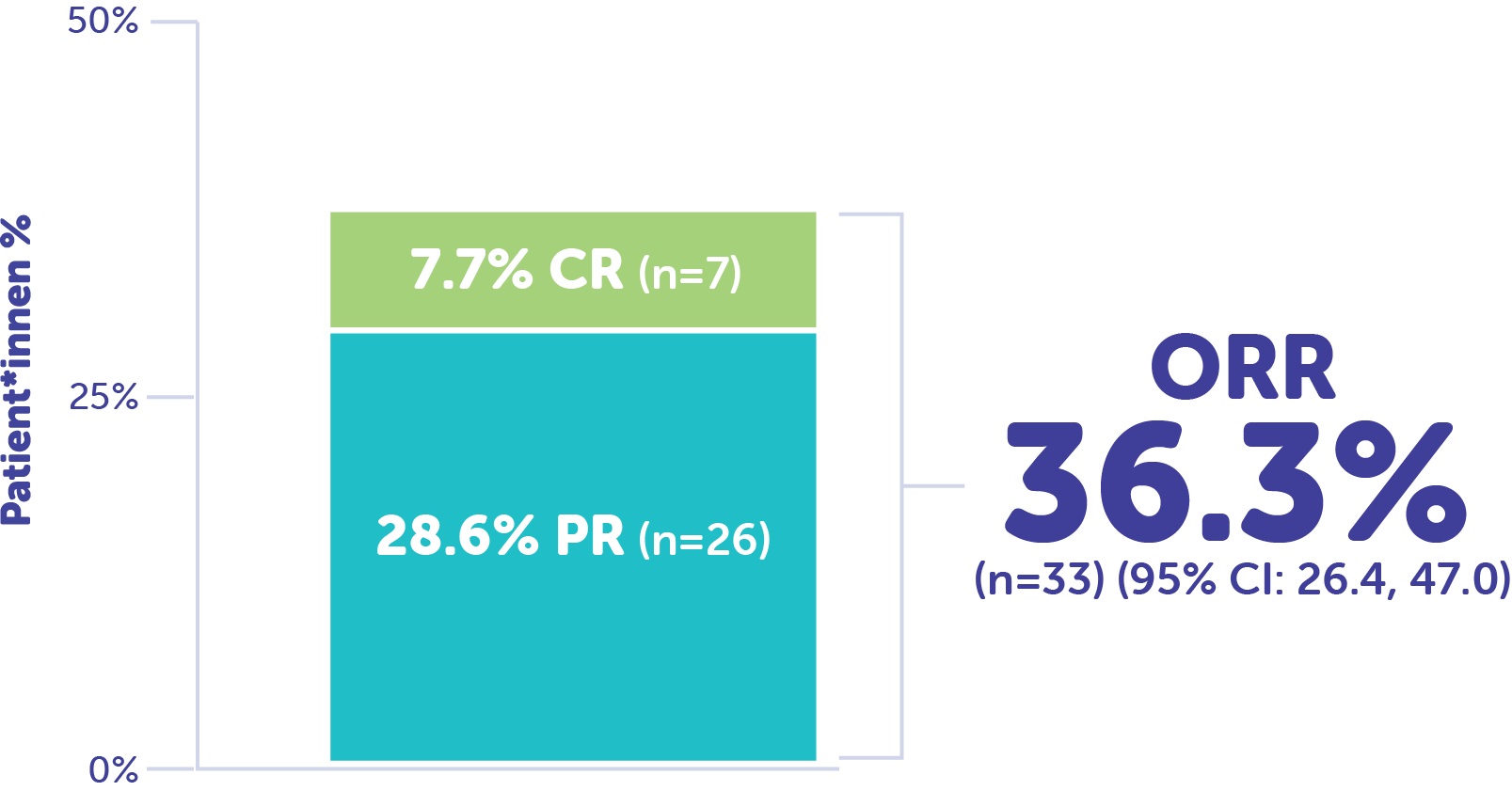

CR: Verschwinden aller Zielläsionena
PR: ≥ 30 % Abnehmender Langachsendurchmesser der Tumorzielläsionenb
aAlle pathologischen Lymphknoten (Ziel- oder nicht-Ziel) müssen einen Durchmesser der Kurzachse von <10 mm aufweisen. Bei nicht-Zielläsionen: Verschwinden aller nicht-Zielläsionen und Normalisierung des Tumormarkerniveaus.5
bVerwendung der Nullwertsumme als Referenz.5
cBerechnet nach der Kaplan-Meier-Methode.4
Sicherheit: Nachgewiesene
Sicherheit und Verträglichkeit4
Die häufigsten Nebenwirkungen (>30% der Patient*innen)
• Übelkeit • Erschöpfung • Muskel-Skelett-Schmerzen
• Bauchschmerzen • Erbrechen
Alle unerwünschten Ereignisse bei Patient*innen mit einer Häufigkeit von >10%
| Alle Grade, % | Grad 3 oder 4, % | |
|---|---|---|
| Magen-Darm-Erkrankungen | ||
| Übelkeit | 57 | 0 |
| Bauchschmerzena | 39 | 1 |
| Erbrechena | 35 | 0 |
| Durchfalla | 17 | 1 |
| Allgemeine Erkrankungen | ||
| Erschöpfunga | 65 | 0 |
| Pyrexiea | 16 | 0 |
| Erkrankungen des Muskel- und Skelettsystems und des Bindegewebes | ||
| Muskel-Skelett-Schmerzena | 46 | 1 |
| Leistenschmerzen | 11 | 0 |
| Atemwegserkrankungen | ||
| Dyspnoea | 23 | 2 |
| Hustena | 15 | 0 |
| Erkrankungen des Nervensystems | ||
| Kopfschmerzena | 19 | 0 |
| Lethargie | 12 | 0 |
| Schwindela | 11 | 0 |
| Verletzungs- und eingriffsbedingte Komplikationen | ||
| Prellung | 17 | 0 |
| Stoffwechsel- und Ernährungsstörungen | ||
| Appetitverlust | 16 | 0 |
| Gefäßerkrankungen | ||
| Hämorrhagiea | 15 | 1 |
| Hypotoniea | 13 | 3 |
aEine Kombination aus mehreren entsprechenden verwandten Begriffen.
Schwerwiegende unerwünschte Ereignisse traten bei 45% der behandelten Patient*innen auf4
Schwerwiegende unerwünschte Ereignisse, die bei ≥2% der Patient*innen auftraten, waren Thrombozytopenie (10%), Neutropenie (8%), febrile Neutropenie (7%), verminderte Thrombozytenzahl (6%), Leukopenie (4,2%), Herzstillstand (3,2%), verringerte Neutrophilenzahl (2,1%), Hypoxie (2,1%), Pleuraerguss (2,1%), Lungenödem (2,1%) und tiefe Venenthrombose (2,1%).4
Tödliche unerwünschte Ereignisse traten bei 3 Patient*innen (3,2%) auf; dazu gehörten Herzstillstand, akute Leberinsuffizienz und bakterielle Peritonitis; sie wurden als nicht behandlungsbedingt angesehen.4,6
Aufgrund unerwünschter Ereignisse wurde die Behandlung bei 18% der Patient*innen dauerhaft abgesetzt, wobei Neutropenie der häufigste Grund war (3,2%).4
Prospektive und retrospektive Studien
Sowohl bei behandlungsnaiven als auch zuvor behandelten Patienten konnte über verschiedene Endpunkte hinweg eine Wirksamkeit nachgewiesen werden.
| N | Behandlungslinie | Tumormerkmale des Patienten | ORR | BS | PFS | Sicherheit | Referenz | |
|---|---|---|---|---|---|---|---|---|
| Prospektive Studie | 35 | 60% Behandlungsnaiv |
Anz. der Metastasen ≥ 10 (57%) | 72% |
1-Jahres-OS - 77% 2-Jahres-OS - 43% mOS 19,1 monate |
7,5 mPFS |
Die meisten entwickelten hämatologische Ereignisse vom Grad 3/4 14 nicht-hämatologische Ereignisse vom Grad 3 |
Meijer, T., et al 20205 |
| Retrospektive Studien | 81 | 54% Behandlungsnaiv |
> 10 Läsionen/>50% Volumenersatz (51,9%) | 60,5% | mOS 14,9 monate | 8,4 mPFS |
Ereignisse vom Grad 3/4 wurden bei 27,7% der Patienten beobachtet | Modi, S., et al 20226 |
| 51 | 43,1% Behandlungsnaiv |
Oligometastatische Erkrankung ≤ 3 Ablagerungen (23,5%) > 10 Läsionen/>50% Volumenersatz (31,4%) |
47% | mOS 15,3 monate | 8,1 monate |
37,5% nicht-hämatologische Ereignisse Grad 3-4 | Karydis, I., et al 20171 | |
| 19 | 31% Behandlungsnaiv |
Nicht berichtet | 53% | mOS 16,7 monate | 14,03 monate |
2 Fälle, Grad 3a (koronare Ischämie)
1 Fall, Grad 3b (transfemorale Blutung nach Operation) |
Bruning, R., et al 20202 | |
| 16 | 25% Behandlungsnaiv |
Die Leberläsionen reichten von 3 bis > 20
Mediane Tumorlast von 22,5% (Interquartilbereich 10 bis 25%) |
60% | mOS 27,4 monate | 11,1 mPFS |
Ereignisse vom Grad 3/4 wurden bei 43,8% der Patienten beobachtet | Artzner, C., et al 20197 |
ORR – Gesamtansprechrate; PFS – progressionsfreies Überleben; mPFS – medianes progressionsfreies Überleben, OS – Gesamtüberleben; mOS – medianes Gesamtüberleben.